EL PARADIGMA DE SALMONELLA: Estrategias alimentarias de prevención y control
Articulo escrito por: Rafael J. Astorga Márquez1, Belén Huerta Lorenzo2
1/2Departamento de Sanidad Animal. Facultad de Veterinaria de Córdoba
Las estrategias alimentarias se fundamentan en que la principal vía de entrada de Salmonella en el hospedador animal o humano es la vía oral. Estas estrategias están encaminadas a proporcionar y mantener un ambiente hostil en el aparato digestivo que evite o limite el asentamiento y/o proliferación del patógeno. Y para ello, se utilizan dos posibles acciones: (i) modificación de las características y composición de la ración; (ii) administración de diferentes productos o aditivos al pienso.
Vídeo de presentación del profesor Rafael J. Astorga Márquez
Procesado y presentación del alimento
Diferentes estudios epidemiológicos han constatado que la presentación del pienso en harina contribuye decisivamente a la reducción de la presencia de Salmonella en comparación con el pienso granulado. Además, se ha comprobado que existe una correlación entre diversos aspectos relacionados con el procesado y la composición del pienso y la reducción de salmonelosis en las granjas: (i) tamaño de la partícula (grosero > 3 mm); (ii) inclusión de ingredientes fibrosos. Aunque es necesario advertir que todos estos aspectos pueden influir en los índices de conversión y de ganancia de peso diario en los animales.
Por otra parte, la alimentación líquida frente a la alimentación seca ha demostrado ser eficaz en el control de la infección por Salmonella. El efecto es especialmente beneficioso cuando se utiliza dieta líquida pre-fermentada o se incluyen subproductos pre-fermentados ya que inducen una disminución del pH intestinal por la acción de las bacterias ácido-lácticas que inhiben el crecimiento de Salmonella en el tubo digestivo.
Aditivos
Entre las medidas que podemos aplicar para reducir la presión de los agentes zoonósicos en la cadena de producción, la adición de aditivos al pienso es una de las acciones más importantes para el control de salmonela en la granja. Dentro de este grupo de sustancias se

incluyen:
- Aceites esenciales
- Probióticos
- Prebióticos
- Ácidos orgánicos
Aceites esenciales
En el año 2003, la Unión Europea alertaba del incremento de las resistencias bacterianas asociado al uso indiscriminado de los antimicrobianos (AMS) como un problema grave de salud pública (Reglamento 1831/2003/CE). Debido al carácter zoonósico de gran parte de los procesos infecciosos que afectan al hombre, los animales de granja y/o domésticos constituyen un importante reservorio y potencial fuente de bacterias resistentes y MDR.
Los últimos documentos publicados por las agencias europeas de seguridad alimentaria y prevención de enfermedades sobre resistencia antimicrobiana en bacterias zoonósicas, señalan prioritariamente la amplia difusión de cepas multirresistentes del género Salmonella con altos niveles de resistencia frente a enrofloxacina, ceftiofur y trimetoprim-sulfametoxazol (EFSA y ECDC, 2019).
La resistencia antimicrobiana de Salmonella puede deberse a varios determinantes localizados en el cromosoma bacteriano o en plásmidos (Foley y Lynne, 2008; Switt et al., 2009). Estos determinantes genéticos pueden ser responsables de la expresión de mecanismos de resistencia intrínsecos relacionados con la producción de beta-lactamasas, modificación de la composición antimicrobiana por enzimas bacterianas, variaciones de la permeabilidad bacteriana, presencia de bombas de flujo (efflux pumps), o modificaciones de receptores diana.
Como ya comentamos anteriormente, la resistencia antimicrobiana puede producirse también a través de la expresión de mecanismos de resistencia adquirida, que emergen por medio de mutaciones puntuales en genes cromosomiales (p. ej. cepas monofásicas de S. Typhimurium), o a través de la adquisición de elementos móviles tales como plásmidos, transposones o islas genómicas (Switt et al., 2009). La transferencia de resistencia se puede producir directamente entre las mismas especies/géneros de bacterias (horizontal) o entre diferentes (vertical); además, es posible indirectamente a través del medio ambiente (Foley y Lynne, 2008).
La aparición, selección y diseminación de bacterias resistentes a los antimicrobianos se sigue atribuyendo principalmente a la presión selectiva del mal uso y abuso de antibióticos (Sayah et al., 2005); de este modo las bacterias intestinales pueden convertirse en resistentes a algunos compuestos antimicrobianos, y por lo tanto transmitir de forma vertical esta resistencia a salmonelas que ocupen el mismo nicho ecológico.
La caracterización de los factores de virulencia de microorganismos zoonósicos, incluyendo la presencia de genes de resistencia a los antimicrobianos, es de gran importancia para asegurar la protección y promoción de la salud en el concepto más amplio de «un mundo, una salud». Por todo ello, la difusión de bacterias resistentes a los antimicrobianos es una amenaza ampliamente reconocida para la sanidad animal y la salud pública.
Para enfatizar la importancia que implica el estudio de las resistencias bacterianas, es pertinente mencionar que en la última convención de Ginebra sobre salud pública (OMS, 2017, Figura 1), se diseña la primera lista de «patógenos prioritarios resistentes a los antibióticos». En esta lista se incluyen las 12 familias de bacterias más peligrosas para la salud humana entre las cuales se encuentra Salmonella spp. (resistentes a fluoroquinolonas), clasificada en el nivel de prioridad II (elevada). La lista se ha elaborado para tratar de guiar y promover la investigación y desarrollo (I+D) de nuevos antimicrobianos como parte de las actividades de la OMS, siendo la finalidad combatir el creciente problema mundial de la resistencia a los antimicrobianos con directas implicaciones en la salud pública. A continuación, presentamos un esquema sobre la clasificación de las familias bacterianas que representan priorización.
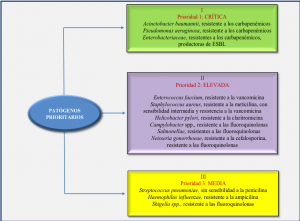
Figura 1. Patógenos prioritarios para la Investigación y Desarrollo (I+D) de nuevos antibióticos (Fuente: WHO, 2017)
Los animales de granja son reservorio y transmisores de bacterias resistentes al hombre debido al contacto directo (zoonosis profesional) y al consumo de productos derivados como alimentos (zoonosis alimentaria, foodborne disease). La creciente inquietud por la seguridad alimentaria en base al paradigma «desde la granja a la mesa», ha propiciado la indagación científica de nuevas alternativas para el control de los microorganismos implicados en toxiinfecciones alimentarias, como es el caso del patógeno Salmonella spp.
Desde la prohibición del uso de los antibióticos como promotores del crecimiento animal con fecha 1 de enero de 2006, se han incrementado los estudios sobre el uso «in vitro» e «in vivo» de nuevas sustancias alternativas, como los ácidos orgánicos, probióticos, prebióticos, enzimas, así como los aceites esenciales (AES) extraídos de plantas y especias. La mayoría d e estos productos se utilizan en sanidad animal como aditivos alimentarios, y su aprobación como terapéuticos precisa de estudios científicos contrastados que demuestren su eficacia antimicrobiana, su efecto sobre la producción animal y su seguridad para la salud pública y medioambiental.
e estos productos se utilizan en sanidad animal como aditivos alimentarios, y su aprobación como terapéuticos precisa de estudios científicos contrastados que demuestren su eficacia antimicrobiana, su efecto sobre la producción animal y su seguridad para la salud pública y medioambiental.
Y así …. «Los aceites esenciales (AES) utilizados por el hombre durante milenios de forma empírica, comenzaron a estudiarse como una posible alternativa para el control de las infecciones por bacterias multirresistentes».
Los AES son una mezcla de sustancias químicas biosintetizadas por las plantas aromáticas como parte de su metabolismo secundario que se extraen por destilación en corriente de vapor o por expresión del material vegetal. Son productos volátiles, no grasos, solubles en alcohol, grasas y aceites vegetales (Mith et al., 2014). En su composición se pueden diferenciar entre 20 y 60 componentes diferentes, de los cuales dos o tres son mayoritarios (>70-80%) y el resto están presentes en trazas. Se considera que sus componentes principales son los que determinan sus propiedades biológicas, si bien se considera que las sustancias presentes en trazas tienen un papel crítico en su actividad antimicrobiana, debido posiblemente a un efecto sinérgico (Bakkali et al., 2008; Pavela, 2015). La proporción de cada sustancia puede variar en un mismo aceite en función de la estación, el origen geográfico y la variedad botánica, entre otros factores, determinando diferencias en sus propiedades farmacológicas y aplicaciones médicas (Peñalver et al., 2005). Los aceites esenciales que poseen notables propiedades antimicrobianas contienen generalmente un alto porcentaje de compuestos fenólicos como carvacrol y timol, capaces de alterar la membrana citoplasma, el flujo de electrones y el transporte activo, provocando la coagulación de los contenidos celulares y la muerte de la bacteria (Belato et al., 2018).
Durante las primeras investigaciones se multiplicaron los ensayos para valorar la actividad antimicrobiana de un gran número de AES frente a un amplio espectro de microorganismos patógenos, utilizando métodos no estandarizados, lo que complicó enormemente la comparación de resultados.
Los trabajos de nuestro grupo de investigación de la Universidad de Córdoba (AGR-256. Sanidad Animal: diagnóstico y control de enfermedades), ya destacaron el notable potencial de los aceites de canela, clavo, orégano y tomillo frente al grupo de las Enterobacterias (Huerta et al., 2004; 2005). Desde entonces, la mayoría de los estudios que se han publicado se han limitado a determinar la Concentración Mínima Inhibitoria (CMI), y más atípicamente la Concentración Mínima Bactericida (CMB), frente a cepas de cultivos tipo y/o un número reducido de cepas clínicas (Burt et al., 2005; Doran et al., 2009; Luz et al., 2012).
Actualmente, los resultados obtenidos por nuestro grupo de investigación sobre la distribución de la susceptibilidad de cepas clínicas de Salmonella spp. de origen animal frente a los AES, aportan una información de gran relevancia sobre la CMI90 y la CMB90 (Solarte et al, 2018) con variaciones significativas con respecto a los valores medios descritos en trabajos previos (De Oliveira et al., 2013); nuestro estudio in vitro comprobó asimismo el carácter bactericida de los AES ensayados y demostró diferencias significativas en la susceptibilidad de los serotipos Typhimurium y Enteritidis a los aceites de canela y clavo, así como la detección de cepas del serotipo Typhimurium con un posible perfil de multirresistencia a los AES (Tabla 1). No obstante, una de las grandes ventajas de los AE frente a los antimicrobianos tradicionales, referidas por diversos autores, es la reducida resistencia y/o tolerancia que generan, debido probablemente al hecho de que sus diferentes componentes químicos pueden desarrollar múltiples mecanismos de acción y atacar diversos objetivos celulares (Nazzaro et al., 2013; Yap et al., 2014). En su contra tienen un considerable efecto citotóxico sobre las células epiteliales a dosis, en algunos casos, muy próximas a las CMI.
Tabla 1. CMI90 y CMB90 obtenida por Solarte et al. (2018) para diversos aceites esenciales frente a 23 serotipos de Salmonella enterica subsp. enterica.
| Aceite esencial | CMI90 y CMB90 (µg/ml) |
| Canela | 1250 |
| Clavo | 1250 |
| Orégano | 625 |
| Tomillo rojo | 625 |
| Tomillo vulgar | 625 |
CMI90: menor concentración de producto capaz de inhibir al 90% de las cepas ensayadas.
CMB90: menor concentración de producto capaz de eliminar al 90% de las cepas ensayadas.
A pesar de sus reconocidas propiedades antimicrobianas y su uso generalizado en alimentación animal, existe un notable escepticismo en el mundo científico y profesional hacia los AES, por lo que es difícil que sustituyan a los AMS. Es por ello, que se están desarrollando numerosas sus investigaciones para valorar el efecto combinado de estas sustancias naturales con los antimicrobianos tradicionales como una opción eficaz para reducir la resistencia bacteriana y las dosis de administración (Da Silva et al., 2016; Yap et al., 2014).
En este sentido, nuestras investigaciones constatan que los AES ensayados presentan efecto sinérgico con los principales AMS de uso común frente a Salmonella (Enrofloxacina, Ceftiofur y Trimetoprim-Sulfametoxazol), destacando el alto porcentaje de sinergias totales del SXT con los cuatro AE y la reducción en hasta 64 veces de la concentración efectiva de ENR alcanzada al combinarla con el AES de canela (Solarte et al., 2017). Estos resultados coinciden con los hallados por otros autores (Da Silva et al., 2016), si bien se desconoce todavía mucho sobre los mecanismos de acción que provocan estas sinergias.
Probióticos
Los probióticos son preparados a base de microorganismos viables que administrados con el alimento producen un efecto beneficioso sobre la salud del hospedador. Estos microorganismos añadidos suelen ser bacterias acidolácticas o Lactobacillus presentes de forma natural en la microbiota intestinal de los animales sanos.
Los mecanismos en los que se basa la actuación de los probióticos son:
Ocupación física del tubo digestivo (nicho ecológico) y de los puntos de adhesión de las células intestinales.
- Competencia por nutrientes.
- Producción de ácidos grasos volátiles.
- Reducción del pH intestinal.
- Estimulación de la inmunidad local (IgA).
Actualmente, se entiende por probiótico:
«Microorganismos vivos que administrados en cantidad adecuada ejercen un efecto beneficioso sobre la salud del huésped» (FAO, 2001).
Pueden estar constituidos por un solo tipo de microorganismo o por combinaciones de estos, con el fin de lograr mayores beneficios. Principalmente, se utilizan bacterias de los géneros Lactobacillus, Bacillus, Bifidobacterium, Enterococcus, Lactococcus, Streptococcus y Pediococcus, capaces de llegar vivas (en un porcentaje variable según la especie) al colon, gracias a su estabilidad en medio ácido y resistencia a las sales biliares (Tabla 2) (Bezkorovainy, 2001; Díaz-López et al., 2017). El efecto del probiótico dependerá de la cepa(s) utilizadas, la dosis, la duración de su uso y la especie de destino, por lo que para ser considerado probiótico es necesario que se hayan realizado estudios que demuestren específicamente sus beneficios en unas determinadas condiciones (OMG, 2011).
Numerosos estudios han demostrado la eficacia de la administración de probióticos en producción primaria para reducir el riesgo de contaminación de productos alimentarios de cerdos y aves de corral con Salmonella spp. En la siguiente tabla se detallan algunos de los probióticos estudiados en los últimos años.
Tabla 2. Ejemplos de probióticos ensayados frente a Salmonella spp. en los últimos años.
| Probiótico | Especie | Efecto |
| Bacillus subtilis | Broiler | Reduce y evita la colonización intestinal por S. Enteritidis |
| Lactobacillus johnsonii | Broiler | Reduce el número de S. sofia en la microbiota intestinal y aumenta la resistencia a la colonización |
| Lactobacillus spp. + Sccharomyces cerevisiae | Broiler | Reduce la colonización intestinal por Salmonella Enteritidis. Eliminación completa a las 4 semanas post-infección |
| E. coli Nissle 1917 | Cerdo | Eliminación de los signos clínicos, cambios histopatológicos y reacción inflamatoria asociada a la infección por S. Typhimurium |
Los principales mecanismos de acción a través de los cuales los probióticos ayudan a estabilizar la microbiota intestinal son (Díaz-López et al., 2017; Tormo, 2006):
- Reducción del pH intestinal (< 4), por la producción de ácidos grasos de cadena corta, ácido láctico o peróxido de hidrógeno, lo que impide el crecimiento de las bacterias no tolerantes al ácido, favorece la producción de bacterinas y reduce la inflamación de la mucosa gástrica.
- Exclusión competitiva: al colonizar ampliamente el intestino, los microorganismos probióticos compiten con las bacterias patógenas para adherirse a la mucosa intestinal, disminuyen su posibilidad de obtener nutrientes y dificultan su proliferación. Este mecanismo es más eficaz en animales jóvenes, cuyo intestino aún está en desarrollo.
- Los lactobacilus y bifidobacterias pueden segregar antibióticos naturales de amplio espectro, acortando la duración de la diarrea tras 2-3 días de administración.
- Aumentan la expresión de las mucinas ileocolónicas MUC2 y MUC3. La mucina desarrolla funciones de lubricación y protección de la mucosa intestinal y actúa como filtro de agentes nocivos, constituyendo un mecanismo inespecífico, pero muy eficaz, de lucha antibacteriana.
- Estimulación del sistema inmune innato y celular, aumentando la actividad de las células Natural Killer (NK), con efecto citotóxico y productoras de citoquinas que actúan como inmunomoduladores. Los microorganismos probióticos, especialmente los productores de ácido láctico contribuyen, además, a la modulación de la respuesta inmune mediada por el tejido linfoide asociado al intestino (GALT por sus siglas en inglés Gut-associated lymphoid tissue).
- Efecto quimiotáctico: a través de citoquinas, metaloproteinasas y prostaglandinas, los probióticos estimulan la migración de los linfocitos T hacia los órganos diana, lo que contribuye a la presentación del antígeno.
Prebióticos
El término prebiótico hace referencia a ingredientes alimenticios no digeribles (como los oligosacáridos) que dan lugar a cambios específicos en la composición y/o la actividad de la microbiota beneficiosa gastrointestinal, confiriendo así beneficios a la salud del huésped (OMG, 2011).
Como consecuencia de la fermentación del microbiota intestinal se liberan a la luz intestinal ácidos grasos de cadena corta (AGCC), reduciendo el pH y favoreciendo el crecimiento de las bifidobabacterias en detrimento de ciertas poblaciones de la microbiota intestinal que pueden tener efectos perjudiciales (Bacteroides, Fusobacterium y Clostridium). Los estudios en humana describen, además, un efecto protector frente a las infecciones intestinales y las diarreas producidas por el tratamiento con antibióticos, debido probablemente al bloqueo que ejercen sobre los lugares de adhesión de los microorganismos patógenos o sus toxinas en el epitelio intestinal (Olveira y González-Molero, 2016).
Otras propiedades atribuidas a los prebióticos son el aumento del peso corporal, la conversión alimenticia, el peso de la canal y la densidad de las vellosidades intestinales. No obstante, al igual que en el caso de los probióticos, el efecto final dependerá mucho de la higiene medioambiental y el estrés de los animales (Yusrizal y Chen, 2003).
Tabla 3. Ejemplos de prebióticos ensayados frente a Salmonella spp. en los últimos años.
| Prebiótico | Especie | Efecto |
| Fructo-oligosacáridos (FOS) | Cerdo | Prevención de la infección por Salmonella |
| Fructo-oligosacáridos (FOS) | Ratón | Aumento de la respuesta inmune para la vacuna de Salmonella |
| Manano-oligosacáridos (MOS) | Broiler | Inhibición del crecimiento de Salmonella spp. |
| Manano-oligosacáridos (MOS) | Pollos 1 día | Reducción significativa de la colonización cecal por S. Enteritidis, inducción de citoquinas y aumento del microbiota intestinal beneficiosa |
| Galacto-oligosacáridos (GOS) | Pollos 1 día | Reducción no significativa del número de S. Typhimurium y S. Enteritidis. Alteración del transporte de salmonela por modificación de la expresión del gen de la amígdala y el microbioma cecal |
Finalmente, los simbióticos son productos que contienen probióticos y prebióticos. En sentido, estricto el término se aplicaría a los productos en los que el componente prebiótico favorece selectivamente al microorganismo probiótico (p. ej. la combinación de oligofructosa y bifidobacterias). Si bien, en muchas ocasiones se considera simbiótico cualquier combinación con un efecto sinérgico sobre la microbiota gastrointestinal del huésped (ej. oligofrutosa con Lactobacillus (L) casei) (Olveira y González-Molero, 2016).
Tabla 4. Ejemplos de simbióticos ensayados frente a Salmonella spp. en los últimos años.
(Fuente: adaptado de Markowiak y Slizewska, 2019)
| Simbióticos | Especie | Efecto |
| Manano-oligosacárido + ácido butírico + Pediococccus acidilactici | Broiler | Recuperación completa de los efectos de la infección experimental por
S. Typhimurium |
A pesar de las numerosas dificultades asociadas con el registro de aditivos para piensos, particularmente en la categoría de aditivos para piensos zootécnicos, la moderna economía global y la fuerte competencia del mercado han dado como resultado la necesidad de implementar nuevas tecnologías en la nutrición animal. Numerosos informes científicos confirman un efecto beneficioso de los probióticos sobre la sanidad animal: (i) protección frente a patógenos; (ii) estimulación de la respuesta inmunitaria; (iii) mejora de la producción animal. Por su parte, los prebióticos pueden utilizarse como alternativa o potenciar el efecto de los probióticos.
La combinación de estos aditivos que muestran un efecto sinérgico puede ser aún más eficaz en la estimulación de la microbiota intestinal y por ende, la protección de la sanidad animal. El mayor problema de las diferentes investigaciones actuales para diseñar formulaciones simbióticas es la adecuada selección de probióticos y prebióticos (elevada selectividad de acción). Los alimentos que contienen organismos probióticos son una gran esperanza; la esperanza es aún mayor considerando que los consumidores no aceptan alimentos procedentes de animales tratados con antimicrobianos.
Cabe destacar que el uso de aditivos para harinas y piensos, como los probióticos, prebióticos y simbióticos es seguro, no tiene un impacto negativo en el medio ambiente y reduce la necesidad del uso de antimicrobianos promotores del crecimiento. Sin embargo, los mecanismos de acción de los organismos probióticos y prebióticos, así como sus combinaciones en forma de simbióticos, requieren más estudios científicos para poder establecer pautas de administración eficaces (…).
Ácidos orgánicos
Los ácidos orgánicos de cadena corta como aditivos al pienso pueden controlar de forma efectiva la proliferación de Salmonella en el aparato digestivo. Los productos más utilizados son el ácido fórmico, el ácido acético, el ácido fumárico, el ácido propiónico y el ácido butírico.
Gracias a su estructura bioquímica, estos ácidos pueden atravesar fácilmente la membrana polisacárida de las bacterias GRAM negativas (p. ej. Salmonella, Escherichia coli), induciendo la acumulación de aniones en su interior provocando la muerte o lisis bacteriana. Para tal fin, es imprescindible alcanzar las concentraciones adecuadas del ácido empleado y mantener una proporción importante del mismo en su forma no disociada. En este sentido y como ejemplo práctico podemos recomendar el uso de derivados del ácido butírico durante las 6-8 semanas previas a la finalización del cebo administrado en premezcla a razón de 5 kg/ton pienso (mínimo).
Por otra parte, y al igual que en el caso de los aceites esenciales, son cada vez más frecuentes las presentaciones «encapsuladas» que consiguen un efecto by-pass del estómago y concentraciones activas y con ello eficaces en el intestino.
El efecto de la administración de ácidos orgánicos en el pienso es muy variable en función de los componentes de la ración. Estas sustancias ejercen su acción sobre la microbiota intestinal principalmente por dos mecanismos: a) reduciendo el pH del alimento y del tracto digestivo (especialmente en su tramo proximal), lo que inhibe el crecimiento de Escherichia coli, Clostridium spp. y Salmonella spp., y b) por un efecto antimicrobiano específico de su forma no disociada, capaz de alterar varios procesos esenciales para la supervivencia bacteriana, como la interacción del adenosín trifosfato con el fosfato inorgánico (Gonzáles et al., 2013). De esta forma, la actividad de un ácido orgánico depende de la cantidad de producto que se encuentra en su forma no disociada, determinada a su vez por el valor de su pKa. Los ácidos de cadena corta, con un pKa entre 3 y 5 son los más eficaces (Dibner y Buttin, 2002).
Se consideran sustancias seguras , ya que no abandonan el tracto digestivo (TGI) y, por tanto, no dejan residuos en los productos animales. Son absorbidos rápidamente a lo largo del TGI siendo difícil aumentar su concentración en el tramo posterior del intestino, salvo que se administren microencapsulados (Gonzáles et al., 2013).
Diversos ácidos orgánicos (fórmico, fumárico, propiónico y sórbico) han sido utilizados en el pienso concentrado de pollos de engorde con una respuesta positiva en el rendimiento productivo. El ácido láctico, fórmico y propiónico han demostrado, además, una reducción en la incidencia de Salmonella en el TGI y la canal de pollos y cerdos (Gonzáles et al., 2013; Willamila et al., 2011). Con respecto a otras medidas de control habitualmente utilizadas en cerdos de acabado, los ácidos orgánicos han mostrado mayor eficacia que la desinfección de las tolvas de alimentación, la vacunación y la adición de tetraciclinas en el pienso (Wilhelm et al., 2012). Por su parte, trabajos recientes sobre el uso combinado de aceites esenciales y ácidos orgánicos (timol + ácido benzoico y cinamaldehido + ácido caproico) describen una reducción en el recuento de salmonela a nivel cecal similar al alcanzado con las fluoroquinolonas tras 5-7 días de tratamiento, así como una notable reducción de la infección experimental a nivel hepático y esplénico (Zhang et al., 2019).
En el estudio continuo de nuevas alternativas a los promotores del crecimiento animal, las últimas investigaciones describen la utilización de fragmento pequeños de ARN para el control de salmonela. Estas pequeñas cadenas podrían regular la expresión de genes implicados en la invasión de las células epiteliales y determinantes de la virulencia de la bacteria presentes en la región cromosómica conocida como isla de patogenicidad de Salmonella (SPI-1), mediante la interacción con la región terminal del ARN mensajero correspondiente (El Mouali et al., 2018).
Como corolario, estudios recientes (Gómez-García et al., 2019) han demostrado la efectividad del ácido fórmico frente a aislados de Salmonella spp. de origen porcino. Asimismo, en estos ensayos se ha comprobado el efecto sinérgico de este ácido orgánico en combinación con los aceites esenciales carvacrol y timol.
Referencias bibliográficas:
- Bakkali, F., Averbeck, S., Averbeck, D., and Idaomar, M. (2008). Biological effects of essential oils–a review. Food and Chemical Toxicology, 46(2), 446-475.
- Belato, K.K., de Oliveira, J.R., de Oliveira, F.S., de Oliveira, L.D. and Camargo, S.E.A. (2018). Cytotoxicity and genotoxicity of thymol verified in murine macrophages (RAW 264.7) after antimicrobial analysis in Candida albicans, Staphylococcus aureus, and Streptococcus mutans. Journal of Functional Foods 40, 455-460.
- Burt, S.A., Vlielander, R., Haagsman, H.P., and Veldhuizen, E.J. (2005). Increase in activity of essential oil components carvacrol and thymol against Escherichia coli O157: H7 by addition of food stabilizers. Journal of Food Protection, 68(5), 919-926.
- Da Silva, J. P. L., de Souza, E. F., Della Modesta, R. C., Gomes, I. A., Freitas-Silva, O., & de Melo Franco, B. D. G. (2016). Antibacterial activity of nisin, oregano essential oil, EDTA, and their combination against Salmonella Enteritidis for application in mayonnaise. Vigilância Sanitária em Debate: Sociedade, Ciência & Tecnologia, 4(1), 83-91.
- De Oliveira, T. L. C., de Araújo Soares, R., & Piccoli, R. H. (2013). A Weibull model to describe antimicrobial kinetics of oregano and lemongrass essential oils against Salmonella Enteritidis in ground beef during refrigerated storage. Meat Science, 93 (3), 645-651.
- Doran, A. L., Morden, W. E., Dunn, K., & Edwards‐Jones, V. (2009). Vapour–phase activities of essential oils against antibiotic sensitive and resistant bacteria including MRSA. Letters in Applied Microbiology, 48(4), 387-392.
- Foley, S.L., and Lynne, A.M. (2008). Food animal-associated Salmonella challenges: Pathogenicity and antimicrobial resistance. Journal of Animal Science, 86, 14, (Apr2008), pp. E173–E187, ISSN 0021-8812.
- Gómez-García M, Sol C, de Nova PJG, Puyalto M, Mesas L, Puente H, Mencía-Ares Ó, Miranda R, Argüello H, Rubio P, Carvajal A. (2019). Antimicrobial activity of a selection of organic acids, their salts and essential oils against swine enteropathogenic bacteria. Porcine Health Management. 27 (5): 32. doi: 10.1186/s40813-019-0139-4.
- Huerta, B., Gutiérrez, J., Astorga, R., Borge, C., Carbonero, A., García, I. y Perea, A. (2004). Actividad in vitro de 27 aceites esenciales frente a cepas de Salmonella enterica subsp enterica serotipos Enteritidis y Typhimurium. IX Simposio Anual Avedila. Córdoba – España.
- Huerta, B., Ponsa, F., Ordóñez, G., Fernández, N., Peñalver, P. (2005). Estudio de eficacia de aceites esenciales ante una infección experimental de Salmonella Enteritidis en gallinas ponedoras en producción. XLII Simposium Científico de Avicultura. Cáceres – España.
- Luz, I., Neto, N. J. G., Tavares, A. G., Nunes, P. C., Magnani, M., & de Souza, E. L. (2012). Evidence for lack of acquisition of tolerance in Salmonella enterica serovar Typhimurium ATCC 14028 after exposure to subinhibitory amounts of Origanum vulgare essential oil and carvacrol. Applied and Environmental Microbiology, 78(14), 5021-5024.
- Markowiak, Paulina y Slizewska, Katarzyna. (2019). El papel de los probióticos, prebióticos y simbióticos en la nutrición animal. Revista Producción Animal. Vol. 316 (septiembre-octubre, 2019). Pp. 58-72.
- Mith, H., Dure, R., Delcenserie, V., Zhiri, A., Daube, G., and Clinquart, A. (2014). Antimicrobial activities of commercial essential oils and their components against food‐borne pathogens and food spoilage bacteria. Food Science and Nutrition, 2(4), 403-416.
- Nazzaro, F., Fratianni, F., De Martino, L., Coppola, R., & De Feo, V. (2013). Effect of essential oils on pathogenic bacteria. Pharmaceuticals, 6(12), 1451-1474.
- [OMS] Organización Mundial de la Salud. (2017): Plan de acción mundial sobre la resistencia a los antimicrobianos. OMS Report, (4), 1-30. ISBN 978 92 4 350976 1.
- Peñalver, P., Huerta, B., Borge, C., Astorga, R., Romero, R., and Perea, A. (2005). Antimicrobial activity of five essential oils against origin strains of the Enterobacteriaceae family. Acta Pathologica, Microbiologica, et Immunologica Scandinavica, 113, 1-6.
- Reglamento 1831/2003/CE del Parlamento Europeo y del Consejo de 22 de septiembre, sobre los aditivos en la alimentación animal. Diario oficial de la Unión Europea. L (268), 29–43.
- Sayah, R.S., Kaneene, J.B., Johnson, Y., Miller, R. (2005). Patterns of antimicrobial resistance observed in Escherichia coli isolates obtained from domestic- and wild animal fecal samples, human septage, and surface water. Applied and Environmental Microbiology, 71, 3, (Mar 2005), pp. 1394–1404, ISSN 0099-2240.
- Solarte, Ana Lucía., Rafael Jesús Astorga, Fabiana Aguiar, Ángela Galán-Relaño, Alfonso Maldonado, and Belén Huerta. (2017). Combination of Antimicrobials and Essential Oils as an Alternative for the Control of Salmonella enterica Multiresistant Strains Related to Foodborne Disease. Foodborne Pathogens and Disease. 14 (10): 558-563.
- Solarte, Ana Lucía., Rafael Jesús Astorga, Fabiana Carolina de Aguiar, Cristina De Frutos, Belén Barrero-Domínguez, and Belén Huerta. (2018). Susceptibility Distribution to Essential Oils of Salmonella enterica Strains Involved in Animal and Public Health and Comparison of the Typhimurium and Enteritidis Serotypes. Journal of Medicinal Food. 21 (9): 946-950.
- Switt, A.I.M., Soyer, Y., Warnick, L.D., Wiedmann, M. (2009). Emergence, distribution and molecular and phenotypic characteristics of Salmonella enterica serotype 4,5,12:i:-. Foodborne Pathogens and Disease, (May 2009), pp. 407–415, ISSN 1535-3141.
- The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2018. EFSA Journal 2019; 17 (12): 5926.
- Yap, P. S. X., Yiap, B. C., Ping, H. C., & Lim, S. H. E. (2014). Essential oils, a new horizon in combating bacterial antibiotic resistance. The Open Microbiology Journal, 8, 6.
Rafael J. Astorga Márquez1, Belén Huerta Lorenzo2
1/2Departamento de Sanidad Animal. Facultad de Veterinaria de Córdoba (sa1asmar@uco.es)